|
Местный
Регистрация: 12.03.2018
Сообщений: 246
Спасибо: 0
Спасибо 6 в 5 постах
Репутация: 10
|
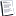
Продолжим.
Как mTORC1, так и mTORC2 содержат несколько общих компонентов: киназу mTOR, которая действует как центральный каталитический компонент, каркасный белок mLST8, регуляторная субъединица mTOR DEPTOR и комплекс Tti1 / Tel2, который важен для сборки и стабильности комплекса mTOR.
Кроме того, каждый комплекс содержит отдельные субъединицы, которые способствуют субстратной специфичности, субклеточной локализации и сложной специфической регуляции. mTORC1 определяется его ассоциацией с Raptor, каркасным белком, важным для сборки, стабильности, субстратной специфичности и регуляции mTORC1, и PRAS40, фактором, который блокирует активность mTORC1 до тех пор, пока передача сигналов рецептора фактора роста не снимет опосредованное PRAS40 ингибирование mTORC1.
Недавно обнаруженная структура mTORC1 показывает, что он действует как димер в форме ромба, причем киназные домены находятся в непосредственной близости друг от друга в центре структуры, а Raptor и mLST8 связываются на периферии.
mTORC2 также разделяет киназу mTOR, mLST8, Tti / Tel2 и DEPTOR, но содержит уникальные компоненты Rictor и mSin1. Рапамицин является известным аллостерическим ингибитором mTORC1, тогда как ингибиторы киназы TOR (TOR-KI) подавляют активность обоих комплексов. mSin1 является ключевым негативным регулятором активности киназы mTORC2 до тех пор, пока передача сигналов, производных от рецептора фактора роста через фосфатидилинозитол-3-киназу (PI3K), не привлекает mSin1 / mTORC2 к плазматической мембране, где опосредованное Sin1 ингибирование mTORC2 не снимается.
Активный mTORC2 тесно связан с плазматической мембраной и был обнаружен в связи с рибосомными мембранами, где он может взаимодействовать со своими ключевыми субстратами, киназами AGC, включая AKT1-3, serum-glukokortikoid-regulierte kinase или serine/threonine-protein kinase (SGK), и члены семейства протеинкиназы C (PKC). Напротив, mTORC1, по-видимому, связан с эндосомными и лизосомальными мембранами, где он взаимодействует со своими эффекторами 4EBP1 и S6K1.
Некоторые стимулы передают сигнал через комплекс туберозного склероза (TSC; включая TSC1 и TSC2). TSC представляет собой GTPase-активирующий белок (GAP) для небольшой протеaзы RHEB (Ras homolog enriched in brain) и отрицательно регулирует mTORC1, способствуя гидролизу RHEB_GTP, превращая RHEB в его неактивное состояние.
Прямые доказательства активности mTORC1 в канцерогенезе исходят от туберозного склероза, заболевания, вызванного потерей TSC1 или TSC2, что приводит к гиперактивации mTORC1 и приводит к широко распространенному, но доброкачественному образованию опухоли. Ограниченное прогрессирование этих опухолей может быть связано с опосредованной mTORC1 отрицательной обратной связью по субстрату рецептора инсулина (IRS) -1, сильно подавляющей передачу сигналов PI3K ниже большинства рецепторных тирозинкиназ (RTK).
mTORC1 является основным регулятором рибосомного биогенеза и синтеза белка посредством фосфорилирования и активации S6K, а также фосфорилирования и инактивации репрессоров трансляции мРНК 4EBP1. Впрочем S6K1 (фосфорилирует S6 -рибосомный белок 40S S6, усиливая трансляцию мРНК ) также может активироваться TOR-нечувствительными сигнальными путями, такими как PDK1, MAPK и SAPK (стресс-активируемая протеинкиназа), но все три сайта фосфорилирования могут блокироваться ингибиторами mTOR.
Имеются данные о том, что mTORC1 регулирует аэробный гликолиз за счет увеличения трансляции фактора, индуцируемого гипоксией (HIF -1α), фактора транскрипции, который управляет экспрессией нескольких гликолитических ферментов. Шунтирование промежуточных продуктов гликолиза в синтез нуклеотидов также частично контролируется mTORC1. mTORC1-обусловленное фосфорилирование S6K1 стимулирует синтез пурина и пиримидина, который необходим для раковых клеток , чтобы быстро дублировать их ДНК.
mTORC1 активирует синтез липидов из промежуточных продуктов гликолиза посредством фосфорилирования Lipin1 и S6K1, таким образом активируя фактор связывания регуляторного элемента транскрипции (SREBP -1), управляя транскрипцией генов, участвующих в липогенезе. Потеря mTORC1-опосредованной активации SREBP1 в клетках рака молочной железы блокирует липогенез, препятствуя пролиферации клеток и росту опухоли.
mTORC1 также негативно регулирует лизосомную деградацию внеклеточного белка, поглощаемого макропиноцитозом, и косвенно регулирует аутофагию, контролируя биогенез лизосом посредством фосфорилирования фактора транскрипции EB (TFEB), который управляет транскрипцией нескольких генов, специфичных для лизосом и аутофагии. mTORC1 и TFEB совместно локализуются на лизосомной мембране, где mTORC1-обеспечиваемое фосфорилирование способствует цитоплазматической секвестрации TFEB.
Последний раз редактировалось albert52; 29.10.2020 в 18:22..
|